| 分布地区: | 东北地区 | 华北地区 | 西北地区 | 华中地区 | 西南地区 | 华东地区 | 华南地区 | 国外 | |||||||||||||||
| 类型: | 病害 | 虫害 | 草害 | ||||||||||||||||||||
| 病害性质: | 侵染性病害 | 非侵染性病害 | |||||||||||||||||||||
| 病害性质: | 贮藏类 | 食叶类 | 刺吸式口器类 | 钻蛀类及穗期发生型 | 地下及苗期发生型 | ||||||||||||||||||
| 病害性质: | 萝藦科 | 酢浆草科 | 鸭跖草科 | 伞形科 | 桑科 | 石竹科 | 大戟科 | 十字花科 | 莎草科 | 禾本科 | 旋花科 | 车前科 | 茜草科 | 锦葵科 | 茄科 | 蔷薇科 | 菊科 | 马齿苋科 | 苋科 | 木贼科 | 蓼科 | 藜科 | 其他 |
| 危害器官: | 穗部 | 叶部 | 茎部 | 根部 | 系统性危害 |
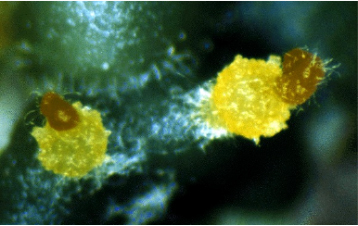
南方火蚁Solenopsis xyloni McCook 隶属于节肢动物门(Arthropoda)、昆虫纲(Insecta)、膜翅目(Hymenoptera)、蚁科(Formicidae)、火蚁属(Solenopsis)
南方火蚁的工蚁体长范围为2.5-5毫米,体色呈现从浅棕到红褐的渐变(Creighton, 1950)。蚁后体长可达6-7毫米,胸部红褐色,腹部深褐色;雄蚁通体黑色,体长5-6毫米。该物种最显著的鉴别特征是触角末端两节形成的锤状结构,以及相对较小的体型。


图1. 南方火蚁(来自GBIF)
南方火蚁的叮咬会引起局部皮肤反应,包括红肿和灼痛感。在农业生产中,该物种会对作物穗部造成直接损害,并污染储存的谷物。USDA 2017年的报告指出,在重发生区,其对某些作物的危害可达显著水平。毒液成分分析显示其毒性低于红火蚁。
南方火蚁主要分布于美国西南部(包括加利福尼亚州、亚利桑那州、得克萨斯州)及墨西哥北部干旱地区,在中国及其他亚洲国家尚无分布记录,属于美洲特有物种。
针对南方火蚁的防治措施包括使用特定配方的饵剂进行诱杀、采用接触性杀虫剂进行巢穴处理和通过农业管理措施降低适宜栖息地质量。
Hooper, L.M., Rust, M.K., and Reierson, D.A. (1998). Using bait to suppress the southern fire ant on an ecologically sensitive site (Hymenoptera: Formicidae). Sociobiology 31, 283-289.
Hill July, J.G.C.P. (2007). Observations of Neivamyrmex fallax Borgmier and Solenopsis xyloni McCook (Hymenoptera: Formicidae). Marginalia Insecta 2, 1-2.
Hooper, L.M., and Rust, M.K. (1997). Food preference and patterns of foraging activity of the southern fire ant (Hymenoptera: Formicidae). Annals of the Entomological Society of America 2, 246-253.
Mackay, W.P. (1990). Destruction of electrical equipment by Solenopsis Xyloni McCook (Hymenoptera: Formicidae). The Pan-Pacific Entomologist 66, 174-175.
黑火蚁Solenopsis richteri Forel 隶属于节肢动物门(Arthropoda)、昆虫纲(Insecta)、膜翅目(Hymenoptera)、蚁科(Formicidae)、火蚁属(Solenopsis)
①工蚁:体型多态,大型工蚁头长1.3-1.4mm,头侧宽椭圆形,后缘具中裂,触角柄节近达后头叶顶端。体色独特,腹第一节背、腹板常具鲜艳橙色斑,头胸为棕褐色,腹后部黑褐色。②蚁后:体长7.5-8.5mm,头略宽于长,复眼大,具发达单眼;腹柄结节较工蚁薄,后腹柄宽大于长;体色与工蚁类似,腹第一节背板具橙色斑,头胸呈黑褐色。③雄蚁:体长6.1-6.5mm,体黑,触角和足黄褐;上颚具2齿,触角柄节极短,腹柄结节呈翼螺母状;全身多直立毛。④幼虫:四龄幼虫体长2.7-3.1mm,头近梨形,体壁具细皱纹。


图1 黑火蚁(来自GBIF)
黑火蚁主要危害农作物穗部(如玉米、大豆种子)及仓储粮食。其工蚁具有强烈攻击性,受干扰时会群起叮咬,注入含哌啶类生物碱的毒液,导致皮肤灼痛、红肿甚至水疱。在农业上,它们取食种子、破坏幼苗,并干扰机械收割;在仓储环境中,污染粮食并降低商品价值。
原产于南美洲的部分地区,如巴西、阿根廷等国家。随着贸易和运输等活动,已扩散到美国南部、墨西哥等部分地区,在其他国家和地区也可能因偶然传入而出现局部的分布。
①饵剂施用方法:在蚁巢边缘10-50cm处将茚虫威(或氟蚁腙、多杀霉素)杀蚁饵剂作点施或环状撒施,注意施药前后不要惊扰和破坏蚁巢。饵剂使用应选择天气晴朗或者多云的白天、夜晚,气温21℃-34℃或地表温度22℃-35℃时为宜,施用后3-4小时有雨,需在雨后地面干燥时补施,不能将饵剂与其它肥料或颗粒剂混用。②粉剂施用方法:扰动蚁巢,待大量红火蚁涌出后,直接将0.2%的高效氯氰菊酯粉剂撒于蚁巢表面和蚁群。
李群臣, 石庆型, 陈婷等. 表皮碳氢化合物在3种火蚁属蚂蚁成虫鉴定中的应用[J]. 环境昆虫学报, 2022, 44(06):1414-1425.
Folgarait, P. J., Bruzzone, O.A., Gilbert, L. E. (2002). Development of Pseudacteon cultellatus (Diptera: Phoridae) on Solenopsis invicta and Solenopsis richteri Fire Ants (Hymenoptera: Formicidae). Environmental Entomology 2, 403-410.
Chen, L., Morrison, L.W. (2021). Importation biological control of invasive fire ants with parasitoid phorid flies—progress and prospects. Biological Control, 154.
墨西哥斑皮蠹,学名:Trogoderma anthrenoides(Sharp),异名:Eucnocerus anthrenoides Sharp,T. ornatum Hinton.,俗名:American serpentine leaf miner 、serpentine leaf miner 和chrysanthemum leaf miner,隶属于鞘翅目(Coleoptera)皮蠹科(Dermestidae)斑皮蠹属(Trogoderma)。
墨西哥斑皮蠹卵散产或集合成块状。初产卵乳白色,长筒形,一端具丝状物。卵产在粮粒间或缝隙内,以丝状物粘附物体,易脱落。
产卵经4~6天孵化成幼虫。1龄幼虫尾端刚毛较长, 为体长的1.5倍,腹部7~8节背板后侧区箭刚毛很少;2龄幼虫腹部7~8节背板后侧常具浓密的箭刚毛簇,尾端刚毛等于体长或稍短;大多数3龄以后幼虫腹部5-8节背板后侧具浓密的箭刚毛簇,可呈明显环带状。老熟幼虫体长4.53~6.87mm(平均5.69mm),宽1.29~1.82mm(平均1.46mm);爬虫式,背面隆起;背板淡褐色,着生黄色至褐色毛。头部窄于前胸。前胸最长。腹部9节,第9节短小。触角3节,长近相等 (1~3节长平均为0.57,0.60,0.58mm);第1节最宽,第3节最窄,第2节宽为第3节的2.5倍,第1节为第2节的1.6倍(1~3节宽平均为0.74,0.45,0.18mm);第1节内侧2/5~1/2区域具刚毛7~9根,最长刚毛短于第2节;同一个体两触角刚毛数有不相同;第2节无刚毛,端部具1个大的感觉孔;第3节端部有长约0.05mm的小尖突,第1个感觉孔位于其基部1/3处。第5~8腹节背板后侧区常具浓密的箭刚毛簇;第9腹节端部有两束约等于体长1/2的长芒刚毛;腹部背板箭刚毛的箭头长等于其后3节长之和,箭刚毛端部第2节长为第3节的2倍,第3节后前数节等宽,连呈线状;第1~8腹节背板前背线明显。上内唇(上唇内面)前端中部两侧各有1根伸向后侧的感觉棒,2根感觉棒中间有1个感觉环,环内有感觉突6个(偶有5个),感觉突排列不规则;上内唇前缘有片状中刚毛4根,内刚毛较宽,外刚毛较长,两侧各有刚毛12根。1龄幼虫腹部第7~8节背板后侧区具少量箭刚毛,第9腹节端部两束长芒刚毛为体长的1.5倍;2龄幼虫腹部第7~8节背板后侧区常具浓密的箭刚毛簇,第9节端部长芒刚毛等于体长或稍短;大多数3龄以后幼虫第5~8腹节背板后侧区常具浓密的箭刚毛簇,可呈明显的带状。
蛹纺锤形,以胸部最宽,头胸部背面披黄褐色长毛,毛端直立呈屋脊状,腹部背面及末端密生褐色毛。
成虫前胸背板加鞘翅长1.9~3mm。背面及腹面黑色,前胸背板及鞘翅有红褐色斑纹,触角及足淡褐色至暗褐色。背面被近直立状粗毛,由黑色、金黄褐色及白色毛组成,腹面被中等粗细的近倒伏状毛。触角11节;雄虫触角伸达前胸基部1/5处,密生直立的细短毛,第3~10节呈栉齿状,第3、4节近等宽,触角棒偏心;雌虫触角伸达前胸基部约1/3处,触角棒4节,第7节略膨扩,第3~6节略等宽。鞘翅上的淡色斑纹形成亚基环、亚中带、亚端带和一条纵带;亚基环向鞘翅侧缘延伸形成亚肩带;亚中带短,不超过翅中缝至翅侧缘距离之半;亚端带多呈斑点状;纵带由亚中带前伸达亚基环中部,有时完全分割亚基环;亚中带与亚端带间无纵带相连。鞘翅表皮的淡色斑纹上着生淡色毛,在亚中带及亚端带侧方散布少数白色毛簇。雄虫的触角窝深,长为宽的3倍,占据前胸背板侧缘的全长;触角窝后缘线隆起呈刀刃状;窝底具细条纹,与触角窝的前侧壁多少垂直。雌虫触角窝的前部深,后2/3十分浅,触角窝后缘线呈脊状隆起,隆脊较低,延伸至前胸背板基角;由前胸腹板前侧角发出一条短脊伸达触角窝中部,该脊与触角窝后缘线形成20~30度夹角;窝底在短脊的前半部有细条纹,在后半部有相互连接的刻点。后胸腹板中区无斜陷线;腹部第1腹板中区具侧陷线,侧陷线由基节窝发出,通常伸达至该腹板长之半。雄虫第1围阳茎背板(腹部第8节背板)端部呈均匀圆形,边缘着生一排刚毛,背板中部区域不骨化;阳基侧突狭窄,近平行,阳茎桥较横向,中度狭窄。
图1 墨西哥斑皮蠹幼虫特征
图2 墨西哥斑皮蠹成虫(昆明海关)
墨西哥斑皮蠹食性较杂,动植物产品均能为害。幼虫喜食大米、玉米、花生仁,在玉米碎粒和大米中生长最好;次为面粉、麦麸、小麦、鱼粉、豆粕等。在上述食物中均能完成其世代繁殖,对完整的大豆粒为害很少。
目前墨西哥斑皮蠹仅分布在美国、墨西哥、西班牙。目前虽尚未传入我国,但已被海关口岸多次截获。
植物检疫:2007年至今,我国农业部、国家质检总局将斑皮蠹属列入正式发布实施的《中华人民共和国进境植物检疫性有害生物名录》。依据我国的实际情况,根据动植物检疫法及实施条例的有关规定,制定墨西哥斑皮蠹更为有效的检疫鉴定方法,严格控制从墨西哥斑皮蠹发生地进口调运农产品,特别是大米、玉米、花生仁等粮食及其产品,降低有害生物传入的风险;实施严格的产地检疫、入境检疫、调运检疫及跟踪检疫,禁止携带墨西哥斑皮蠹的农产品进境和运出疫区。在口岸一旦截获墨西哥斑皮蠹,要立即实施严格的检疫处理措施;加强对墨西哥斑皮蠹的检疫处理技术研究,利用各种技术手段提高防治效果;强化口岸一线的疫情监测工作,建立健全疫情监测网络,及时掌握口岸截获状况,以便对其实施针对性检疫。
Trogoderma anthrenoides (Sharp, 1902) in GBIF Secretariat (2023). GBIF Backbone Taxonomy. Checklist dataset https://doi.org/10.15468/39omei accessed via GBIF.org on 2024-12-12.
张生芳,黄世水,鄢建.警惕墨西哥斑皮蠹传入我国[J].植物检疫,2003,(06):349-351.
黄世水,卢兆山.墨西哥斑皮蠹幼虫形态特征识别[J].植物检疫,2007,(06):356-357.
黄世水,卢兆山,龙顺富,等.墨西哥斑皮蠹生物学特性研究初报[J].检验检疫科学,2005,(01):3-4.
可可花瘿病菌(Albonectria rigidiuscula (Berk.& Broome) Rossman & Samuels)属于菌物界(Fungi)、子囊菌门(Ascomycota)、粪壳菌纲(Sordariomycetes)、肉座菌目(Hypocreales)、从赤壳科(Nectriaceae)、从壳属(Albonectria)
大型分生孢子镰刀形或稍弯的柱形,透明,通常有5~9个隔,大小为(68.5~97.5 μm)×(7.5 ~9.2 μm),比同属的其余种类都大。子囊壳散生或聚生,卵形或球形,大小为(0.27~0.6 mm) ×(0.16~0.4 mm),具4个子囊孢子极少数 2~8个。子囊孢子纺锤形、稍弯曲、两端钝圆锥形,具不明显条纹。在 PDA培养基上菌丝生长速度比较慢,菌落开始为白色,后逐渐变为乳白色至粉红色或黄色。
可可花瘿病菌引起可可新梢顶枯和枝条溃疡,偶尔引起茎腐、果腐和豆荚腐烂以及种子上坏死斑。在花芽、茎基和枝条等侵染部位可形成癌肿,为害茎基和枝条时造成萎焉、畸形、根腐或枯梢。纵切枝杆可见维管束变褐色。
可可花瘿病菌最常感染花瓣,形成花瘿,但肿瘤也会出现在叶柄和受伤的主杆和枝条上。花瘿一般不开花,少有开花的也不能结果。肿瘤半球形,有的很大,直径可达30~40 cm,肿瘤上长有易脱落的绿色颗粒。
该病菌主要通过伤口侵入寄主,侵染来源一是带病种苗,二是病株的残枝落叶,病菌在病组织或土壤中可存活数年。病菌通过土壤、繁殖材料(种子及营养繁殖材料)传播。该病菌主要分布于热带和亚热带地区,包括科特迪瓦、加纳、澳大利亚凯恩斯地区、美国、委内瑞拉、墨西哥、印度、印度尼西亚、圭亚那、古巴、日本、中国(台湾)等国家或地区;为害多种植物,包括荔枝(Litchi chinensisi)、 鳄梨(Persea americana)、芒果(Mangifera indica)、 释迦(Annonasquamosa)等重要经济植物,造成溃疡、肿瘤和顶枯等病害。可可花瘿病菌对可可危害尤为严重,引起枯梢、癌肿等病害,严重时导致可可绝收,给西非地区国家造成重大经济损失。
加强海关检疫检查,严防该病菌在我国大面积传播。
[1] 中华人民共和国出入境检验检疫局. SN/T 3284-2012,可可花瘿病菌检疫鉴定方法[S].
[2] 段丽君,段维军,陈先锋.可可花瘿病菌生物学特性及室内药剂筛选研究[J].植物检疫,2015,29(05):5-8.
[3]段维军,郭立新,段丽君.进境日本罗汉松上可可花瘿病菌的截获鉴定[J].植物病理学报,2014,44(03):309-312.DOI:10.13926/j.cnki.apps.2014.03.011.
[4]李敏,吕燕,陈细红,等.来自台湾地区番荔枝果实上可可花瘿病菌的检疫鉴定[J].果树学报,2022,39(04):644-651.DOI:10.13925/j.cnki.gsxb.20210461.
菜豆细菌性萎蔫病菌(Curtobacterium flaccumfaciens pv. flaccumfaciens (Hedges) Collins and Jones)属于厚壁菌门(Firmicutes),短小杆菌属(Curtobacterium)。
该病菌为短小杆菌,革兰氏阳性,直至略弯或楔形,单个或V、Y形或栅栏状排列,具1~ 3根侧或极鞭,一般大小( 0. 3μm ~ 0. 5μm) × ( 0. 6μm ~ 3. 0 μm)。在酵母膏葡萄糖琼脂培养基上,菌落光滑、完整、低隆,黄色、桔黄色、粉红色或紫色。
该病菌主要寄主为菜豆、绿豆、大豆等,人工接种可侵染玉米等。症状主要有植株萎蔫、褪色,叶片变焦,叶片具深绿色、褐色或红褐色病斑,茎、叶上有水渍状斑;菜豆豆荚病斑黄绿色,豆荚内可见黄色细菌菌脓,种子具黄色病斑。
菜豆细菌性萎蔫病菌是典型的维管束病害,主要靠豆类种子远距离传播。种子子叶带菌传给叶片或直接进入维管束组织,引起系统发病。病菌主要通过伤口进行再侵染。一定条件下,南方根结线虫提供病原侵入的伤口。低温、下雨和大风利于病害发生和流行。目前,菜豆细菌性萎蔫病菌被列入我国进境植物检疫性有害生物名录,在美国、巴西、加拿大、德国等多个国家均有分布。得益于海关检疫的防控措施,我国目前尚未发生该病菌的传播。
加强海关检疫检查,严防该病菌在我国大面积传播。
[1]中华人民共和国出入境检验检疫局. SN/T 1586.1-2005, 菜豆细菌性萎蔫病菌检测方法[S].
[2]牟桂萍,魏霜,胡加谊等.进境澳大利亚绿豆中菜豆细菌性萎蔫病菌的检测[J].植物检疫,2022,36(01):19-24.
藿香蓟【学名:Ageratum conyzoides Linn.】,隶属于菊目(Asterales),菊科(Asteraceae),藿香蓟属(Ageratum)(国门生物安全基础数据信息资源平台)。
一年生草本,高50-100 cm,有时不足10 cm。无明显主根。
茎粗壮,基部径4 mm,或少有纤细的,而基部径不足1 mm,不分枝或自基部或自中部以上分枝,或下基部平卧而节常生不定根。全部茎枝淡红色,或上部绿色,被白色尘状短柔毛或上部被稠密开展的长绒毛。

图1. 藿香蓟茎部形态特征(图源CABI)
叶对生,有时上部互生,常有腋生的不发育的叶芽。中部茎叶卵形或椭圆形或长圆形,长3-8 cm,宽2-5 cm;自中部叶向上向下及腋生小枝上的叶渐小或小,卵形或长圆形,有时植株全部叶小形,长仅1 cm,宽仅达0.6 mm。全部叶基部钝或宽楔形,基出三脉或不明显五出脉,顶端急尖,边缘圆锯齿,有长1-3 cm的叶柄,两面被白色稀疏的短柔毛且有黄色腺点,上面沿脉处及叶下面的毛稍多有时下面近无毛,上部叶的叶柄或腋生幼枝及腋生枝上的小叶的叶柄通常被白色稠密开展的长柔毛。

图2. 藿香蓟及其近似种叶部形态特征(图源CABI)
(a)藿香蓟 (b)紫花藿香蓟
头状花序4-18个在茎顶排成通常紧密的伞房状花序;花序径1.5-3 cm,少有排成松散伞房花序式的。花梗长0.5-1.5 cm,被尘球短柔毛。总苞钟状或半球形,宽5 mm。总苞片2层,长圆形或披针状长圆形,长3-4 mm,外面无毛,边缘撕裂。花冠长1.5-2.5 mm,外面无毛或顶端有尘状微柔毛,檐部5裂,淡紫色。
瘦果黑褐色,5棱,长1.2-1.7 mm,有白色稀疏细柔毛。冠毛膜片5或6个,长圆形,顶端急狭或渐狭成长或短芒状,或部分膜片顶端截形而无芒状渐尖;全部冠毛膜片长1.5-3 mm。花果期全年(植物智)。

图3. 藿香蓟花序形态特征(图源维基百科)
(1)作物病原菌的中间宿主
藿香蓟能够作为许多作物病原菌的中间宿主,如引起广东藿香蓟青枯病的茄科雷尔氏菌(Ralstonia solanacearum),该病菌可以侵染包括番茄,辣椒,花生,茄子等20种植物,同样其也是许多双生病毒科病原的宿主侵染多种粮食及经济作物。因此在农业生产中需要防范其带来的潜在危害(杜浩等,2022)。
(2)化感作用
作为一种入侵杂草,藿香蓟能产生和释放多种化感物质,在新的生境中快速占据生态位。有研究报道,藿香蓟提取液及其挥发物对十字花科、禾本科、豆科及百合科等常见旱地作物如白菜、番茄、油菜、小麦、萝卜、旱稻等具有化感作用,对经济作物具有一定的危害(杜浩等,2022)。
(3)对天敌昆虫的影响
藿香蓟通过引诱效应使区域内昆虫天敌种群富集,或者通过趋避作用减少田间害虫密度。同时,也存在相反的效应(杜浩等,2022)。藿香蓟次生代谢物质能够对小菜蛾产卵产生忌避作用,并对其成虫的生殖能力造成负面影响,但也会干扰小菜蛾的天敌绒茧蜂(Cotssia plutellae)(黄寿山等,2001)。拟澳洲赤眼蜂(Trichogramma confusum)是生物防治中应用较广的一种寄生蜂。刘光华等研究发现,藿香蓟提取物对拟澳洲赤眼蜂的寄生以及蛹的羽化没有显著影响,但对其成蜂存活率具有一定的影响(刘光华等,2007)。
藿香蓟被认为是在欧洲栽培的第一个藿香蓟属种类,在1697年之前就已经在比利时发现(Johnson,1971)。其他早期栽培记录可以追溯到1714年之前的英国和1748年的瑞典(Johnson,1971)。藿香蓟通过从墨西哥到马尼拉的船只被引入菲律宾(Johnson,1971)。
尽管该物种在20世纪40年代之前就已经在东非有记录,但在1960年至1980年之间变得更加频繁(Stadler等,1998)。这种区域性的扩散与农业的发展有关。早期的记录仅限于较高海拔地区,但随着人口增长和相关农业活动的增加(例如在干旱地区的灌溉),这种杂草得以向较低海拔地区传播。随着人口压力的增加,越南高地玉米田中的休耕期缩短,这种杂草在近年来逐渐占据主导地位(Wezel,2000)。藿香蓟于20世纪80年代作为园林花卉植物传入我国,现主要分布于长江流域及以南地区,以广东、香港、广西、福建、云南及海南等地分布较多(朱慧等,2011)。
目前藿香蓟被列为亚洲全境的入侵物种;在非洲的肯尼亚、马约特、摩洛哥、留尼汪岛、坦桑尼亚、南非和乌干达,在北美洲的美国加利福尼亚州,在加勒比地区的古巴,在南美洲的复活节岛,以及大洋洲的大部分地区都有其入侵的记录。据了解,它还在埃塞俄比亚、马拉维、卢旺达和赞比亚等地也具有入侵性(CABI)。
1. 农业防控措施
采取农业预防措施是防止藿香蓟入侵的重要步骤。确保农田、园艺区和其他土地的良好管理,包括定期除草和清除植物残渣。注意减少藿香蓟种子的传播,避免穿着污染的衣物、工具和机械进入其他地区。此外,种植抗性或竞争性植物也可以帮助减少藿香蓟的生长。
2. 物理防控措施
手工除草是一种有效的物理控制方法。将藿香蓟从土壤中彻底拔除,包括根部。确保彻底清除植株和种子,以防止其再生和扩散。
3. 化学防控措施
除草剂已被用于有选择性地控制主要作物中的藿香蓟。如苯甲草酮、丁草胺、2,4-D、MCPA等。
加强宣传和教育意识,提高公众对藿香蓟的认识和识别能力。
CABI.https://www.cabidigitallibrary.org/doi/10.1079/cabicompendium.3572#abstract.
国门生物安全基础数据信息资源平台. http://www.pestchina.com/#/rq/detail/cc7d4f48-25e1-43ff-bfc0-6b75ffa236de.
GISD, 2016. Global Invasive Species Database (GISD). http://www.issg.org/database/welcome/
PROTA, 2016. PROTA4U web database. Wageningen, Netherlands: Plant Resources of Tropical Africa. http://www.prota4u.org/search.asp.
Baker H, 1965. Characteristics and modes of origin of weeds. In: Baker H, Stebbins G, eds. The Genetics of Colonising Species. New York, USA: Academic Press, 147-169.
Sauerborn J, 1985. Studies on the segetal flora of taro (Colocasia esculenta (L.) Schott) and on the germination biology of selected weeds of Western Samoa. PLITS (Plant Protection Information Tropics/Subtropics), 3(1):85 pp.
Sauerborn J, Koch W, Krage J, 1988. On the influence of light, temperature, depth of burial and water stress on the germination of selected weed species. Zeitschrift für Pflanzenkrankheiten und Pflanzenschutz, Sonderheft, 11:47-53.
Marks MK, Nwachuku AC, 1986. Seed-bank characteristics in a group of tropical weeds. Weed Research (Oxford), 26(3):151-157.
PROSEA, 2016. Plant Resources of South-East Asia. http://uses.plantnet-project.org.
Johnson M F, 1971. A monograph of the genus Ageratum L. Compositae-Eupatorieae. Annals of the Missouri Botanical Garden. 58 (1), 6-88. DOI:10.2307/2394925.
Stadler J, Mungai G, Brandl R, 1998. Weed invasion in East Africa: insights from herbarium records. African Journal of Ecology, 36(1):15-22; 15.
Wezel A, 2000. Weed vegetation and land use of upland maize fields in north-west Vietnam. GeoJournal, 50(4):349-357; 31.
朱慧, 吴双桃, 2011. 华南地区入侵杂草藿香蓟叶挥发油的成分鉴定. 西北林学院学报, 26(06):100-106.
植物智. 《中国植物志》第74卷 (1985), 053页, 藿香蓟 Ageratum conyzoides.
杜浩, 朱文, 赵丽娟等, 2022. 藿香蓟在农业中的利用及其潜在风险研究进展. 亚热带农业研究, 18(03):211-216.
黄寿山, 潘丽群, 曾玲等, 2001. 胜红蓟次生物质对小菜蛾田间种群的控制作用. 植物保护学报, (04):357-361.
刘光华, 曾玲, 梁广文等, 2007. 胜红蓟提取物对拟澳洲赤眼蜂的影响. 广东农业科学, (6):57-59.
飞机草(Chromolaena odorata),隶属于菊科(Asteraceae),飞机草属(Chromolaena)
飞机草,多年生草本,根茎粗壮,横走。茎直立,高1-3 m,苍白色,有细条纹;分枝粗壮,常对生,水平射出,与主茎成直角,少有分披互生而与主茎成锐角的;全部茎枝被稠密黄色茸毛或短柔毛。叶对生,卵形、三角形,长4-10 cm,宽1.5-5 cm,质地稍厚,有叶柄,柄长1-2 cm,上面绿色,下面色淡,两面粗涩,被长柔毛及红棕色腺点,下面及沿脉的毛和腺点稠密,基部平截或浅心形或宽楔形,顶端急尖,基出三脉,侧面纤细,在叶下面稍突起,边缘有稀疏的粗大而不规则的圆锯齿或全缘或仅一侧有锯齿或每侧各有一个粗大的圆齿或三浅裂状,花序下部的叶小,常全缘。头状花序多数或少数在茎顶或枝端排成伞房状或复伞房状花序,花序径常3-6 cm,少有13 cm的。花序梗粗壮,密被稠密的短柔毛。总苞圆柱形,长1 cm,宽4-5 mm,约含20个小花;总苞片3-4层,覆瓦状排列,外层苞片卵形,长2 mm,外面被短柔毛,顶端钝,向内渐长,中层及内层苞片长圆形,长7-8 mm,顶端渐尖;全部苞片有三条宽中脉,麦杆黄色,无腺点。花白色或粉红色,花冠长5 mm。瘦果黑褐色,长4 mm,5棱,无腺点,沿棱有稀疏的白色贴紧的顺向短柔毛。

图1 飞机草的形态特征(中国植物图像库,2024)
a. 花序;b. 叶片;c. 瘦果
飞机草是对农牧业生产有严重危害的恶性杂草,农业部和国家质检总局共同发布并实施的《进境植物检疫性有害生物名录》,对我国植物检疫工作更加具有针对性和指导性。
飞机草的危害主要体现在人、畜健康、农牧业生产以及生态环境3个方面。
1. 严重影响人、畜健康危害
飞机草带冠毛的种子和花粉能引起马属动物哮喘病,甚至引起牲畜组织坏死和死亡。叶含香豆素,有毒,能引起人的过敏性疫病,用来垫圈或下田沤肥会引起牲畜的蹄叉或导致人的手脚皮肤炎,因此又被称之为烂脚草,牲畜误食一定量中毒后,走路摇晃,口吐白沫,严重的倒地四肢痉挛,最后心衰而亡。用叶擦皮肤会引起红肿、起泡,误食嫩叶会引起头晕、呕吐,还能引起家畜和鱼类中毒。
2. 对农牧业生产危害
飞机草侵入农耕地及经济林后,危害多种作物,造成粮食减产3-11%,桑叶、花椒减产4-8%,香蕉植株少2~3片叶,矮1 m左右,幼树难以成林,经济林木推迟投产;据不完全统计,由于飞机草的危害,云南省大部分地区的农民每年要歉收2成以上的粮食,同时为防治、根除飞机草,每年每户要多投入100-500元的资金。
3. 对生态环境危害
飞机草的化感作用(allelopathy)不仅可以通过抑制种子萌发和植株生长来排挤本土植物,形成单优群落,而且还可以通过拒食、延迟发育和毒性作用等减少植食性昆虫和大型动物对其取食,从而实现成功入侵,它们通过根系分泌、茎叶淋溶、植株挥发和凋落物分解等形式释放化感物质影响邻近植物的生长,从而使自身在竞争中获得更大的优势。在入侵地区,由于缺乏这些天敌的控制,飞机草生长繁茂,密集成丛,常以成片的单优植物群落出现,侵占宜林荒山和椰林、橡胶林等经济林地,并通过遮荫作用和化感作用抑制其他物种的生长,使自身在新的环境中与本地物种竞争时处于优势地位,进而成功地将本地种排挤掉,大大降低入侵地区的生物多样性。
飞机草原产中美洲,繁殖力极强,是一种具有竞争性的全球性入侵物种,已扩散至非洲、亚洲、大洋洲和西太平洋群岛的大部分热带及亚热带地区。上世纪二十年代作为一种香料植物引种到泰国栽培,1934年在我国云南南部首次发现,后扩散于中国台湾、香港、澳门、海南、广东、广西、云南、贵州等省份,于2023年1月1日起,被列入《重点管理外来入侵物种名录》,是对农牧业生产有严重危害的恶性杂草。
飞机草是喜热性杂草,主要分布于30°N-30°S、海拔500-1500 m温暖潮湿的热带、亚热带地区,尤其以800 m左右的地段最多,随海拔高度的上升其出现的频率逐渐下降;在低海拔地区,飞机草对坡向的反应不明显,但在海拔1000 m以上的山区,其主要分布在30度以下的阳坡或平缓地,在年均温高于19℃以及最冷月均温在12℃以上、雨量900-2000 mm、相对湿度75-90%的地带生长特别旺盛。飞机草为喜热性杂草,不耐低温,气温降至1-2℃时,叶密布冷斑,降至0℃时叶片受冻脱落。飞机草对土壤要求不严格,但喜生于肥沃疏松的酸性土壤,不耐碱性土壤,并且它的根表及根基周围有自由的有生物活性的固氮菌,这些固氮菌协助飞机草进行固氮,因此飞机草在贫瘠的土地上也能生长。飞机草对光照要求较严,喜光而不耐阴,但苗期较耐阴。飞机草花期为4-5月(南半球)及9-12月(北半球)。在海南岛1年开花2次,第一次4-5月,第二次9-10月。而在广州地区,飞机草一般在11月至次年2月开花,2-4月结实。主要通过种子繁殖和无性繁殖,但是火灾过后或是原本的茎枯死后,根冠处会重新萌檗。产出的种子数量非常多,估计多达每平方米260,000个,其中大约20-46%的种子能发芽。一些种子存活期长达5年,不论是在土壤的表面或者埋在土壤下,三个月的种子,埋在土壤下时约50%能发芽,在土壤的表面时,约6%能在12个月内发芽,结实。
从飞机草入侵我国并造成危害时起,其防治问题就成了农业、林业、环保部门及相关科技工作者的研究热点,目前已形成了植物检疫、物理防治、化学防治、生物防治等综合防治方法。
(一)强化植物检疫
大力开展飞机草检疫鉴定培训班,提高疫情检出率,能有效防止飞机草入境及扩散。建立植物风险分析制度,通过风险分析,能够科学的判断该种植物对国内的农林业生产安全、生态环境以及人民身体健康产生的危害。在不影响贸易的前提下,加强对进口粮食的检疫监管,对来自飞机草检出率较高、检出批次较多的国家和粮食品种进行重点检验检疫,对生产加工过程实施全程监管,对下脚料实施销毁处理。重点对卸粮码头、运输路线两侧以及加工厂区域及周边进行监测,一旦发现外来杂草定殖,立即采取措施进行铲除并无害化处理,避免扩散为害。
(二)物理防治
物理防治指用人力、火烧或机械的方式清除飞机草,一般先剔除植株的地上部分,再挖掘出根系晒干,此方法对清除入侵初期、尚未形成单优群落的飞机草有一定的作用,但需要的劳动力多,费用较高,且只能实现短期防治。在那些刚刚传入、定殖,还没有大面积扩散的地区可以进行人工措施清除,但是飞机草无性繁殖比较发达,如果有根系残留在土壤中,在适宜的温度条件下,仍然可以萌发,因此拔除必须彻底,对拔除后的植株可以用火烧处理。清除后的土壤必须压实,防止成为残留根系和飞机草种子新的萌发源。对于入侵面积较大的地区,可以用大型机械设备,如推土机将飞机草的主要根系推到土壤表面,再将推出的飞机草根系和地上残体集中在一起焚烧。
(三)化学防治
2,4,5-T毒莠定、麦草畏、绿草定等除草剂都可用于防治飞机草。对飞机草幼苗施用敌百隆(diuron)1.5 kg/hm2和莠去津(atrazine)2.0 kg/hm2可以完全阻止飞机草的生长,对成熟飞机草喷洒草甘膦0.8~1.6 kg/hm2可以完全杀死飞机草。利用三氯吡氧乙酸(900 g/hm2)和氨氯吡啶酸(1200 g/hm2)对飞机草都有较好的防治效果,其中三氯吡氧乙酸在不同生长期的飞机草上均显示出较好的防效,尤其是在生长中期和成株期,其效果优于常用的草甘膦。
(四)生物防治
在加纳和尼日利亚引入飞机草的天敌香泽兰灯蛾Pareuchaetes pseudoinsulata,采食飞机草叶片,损伤飞机草的芽蕾,并将虫卵产于叶片表面,导致飞机草叶片变黄,死亡,取得了较好的防治效果。印度、斯里兰卡和马来西亚的相关研究报道了专门采食飞机草种子的褐黑象甲Apion brunneonigrum,并予以释放观察利用,防治效果较好。国内也已从飞机草上分离到飞机草尾孢菌cercospora euotorii和链格孢菌Aliternaia alternata,有望成为2种有潜力的候选生物除草剂。
郭琼霞, 虞赟, 黄振. 检疫性杂草——飞机草[J]. 武夷科学, 2015, 31(00): 118-122.
余香琴, 冯玉龙, 李巧明. 外来入侵植物飞机草的研究进展与展望[J]. 植物生态学报, 2010, 34(05): 591-600.
刘金海, 黄必志, 罗富成. 飞机草的危害及防治措施简介[J]. 草业科学, 2006, (10): 73-77.
曹洪麟, 葛学军, 叶万辉. 外来入侵种飞机草在广东的分布与危害[J]. 广东林业科技, 2004, (02): 57-59.
喻三鹏. 飞机草在贵州的生物学特性生态影响及适生区预测研究[D]. 贵州大学, 2022.
倪馨营. 两种生境飞机草不同入侵程度下植物-土壤反馈机制研究[D]. 兰州大学, 2023.
潘玉梅, 唐赛春, 李象钦, 等. 氮添加对石漠化区飞机草与本地植物的生长和竞争的影响[J]. 广西科学, 2024, 1-16.
谭亚婷, 左安建, 何彦仪, 等. 飞机草地上部分化学成分及其抑菌活性研究[J]. 天然产物研究与开发, 2021,33(03): 410-418.
白玉文. 飞机草在中国入侵路线、分布危害与防控对策研究[D]. 华南农业大学, 2018.
Madrid M T J. Evaluation of herbicides for the control of Chromolaena odorata[J]. Philippines Weed Science, 1974, 25-29.
Foxcroft L C, Richardson D M. Managing alien plant invasions in the Kruger National Park, South Africa[J]. Plant Invasions Ecological Threats & Management Solutions, 2003: 385-403.
Jinrong W U, Houben Z, Hongfang L U, et al. Effects of soil water regimes on the growth of the exotic invasive plant: Chromolaena odorata[J]. Ecology and Environment, 2007, 16: 935-938.
长芒苋(Amaranthus palmeri S. Watson.),英文名:Carelessweed,Palmer pigweed,Palmer amaranth,隶属于苋科(Amaranthaceae)苋属(Amaranthus)异株苋亚属(Subgen Acnida L.),被我国列为进境植物检疫性有害生物。
长芒苋为一年生草本植物,高0.8-2 m(在原产地有时高达3 m)。浅绿色,雌雄异株。茎直立,粗壮,黄绿色,具绿色条纹,有时呈浅红褐色,无毛或上部散生短柔毛。分枝斜展至近平展。叶片无毛,呈卵形至菱状卵形,茎上部叶呈披针形,先端钝、急尖或微凹,常具小突尖,叶基部楔形,略下延,叶全缘,侧脉每边3-8条。叶柄长纤细。穗状花序生于茎顶和侧枝顶端,直立或略弯曲,长10-25 cm,宽1-1.2 cm,下部花序团簇状。苞片钻状披针形,长4-6 mm,先端芒刺状,雄花苞片下部约1/3具宽膜质边缘,雌花苞片下半部具狭膜质边缘。雄花花被片5,不等长,长圆形,先端急尖,最外面的花被片长3.5-4 mm,具显著伸出的中脉,先端延伸成芒尖。其余花被片长2.5-3 mm,呈钝状至微凹。雄蕊5,短于内轮花被片。雌花花被片5,略外展,不等长,最外面一片倒披针形,长3-4 mm,先端急尖,中脉粗壮,先端具芒尖。其余花被片匙形,长2-2.5 mm,先端截形至微凹,有时呈啮齿状。胞果近球形,长1.5-2 mm,果皮膜质,上部微皱,周裂,包藏于宿存花被片内。种子近圆形或宽椭圆形,直径1-1.2 mm,深红褐色,具光泽。

图1 长芒苋的形态特征(中国植物图像库,2024)
1. 植株;2. 茎;3. 叶片;4. 花序

图2 长芒苋种子(GB/T 40193-2021)
1. 种子整体形态; 2. 种子正面观、侧面观
长芒苋原产于北美,现在欧洲、大洋洲、亚洲、非洲等均有分布,是一种全球恶性杂草。我国于1985年首次在北京发现长芒苋,目前该植物在天津、河北、河南、湖南、广西等地均有记录。
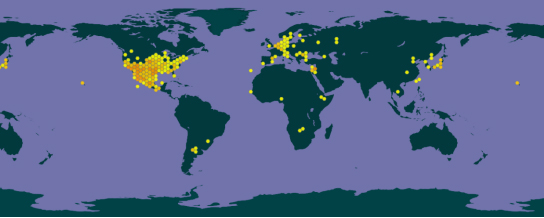
图3 长芒苋的全球分布(GBIF数据库)
长芒苋主要通过营养竞争、传播植物病原、化感作用、抗药性等对本土植物以及农作物造成为害。
1.营养竞争
长芒苋植株生长迅速,生物量积累大,适应性广泛,繁殖系数高,单株结实量达20-60万粒,且因光合作用速率高而使其在生长早期极具竞争优势,通过种群的大量繁殖对本土植物及作物造成营养胁迫。针对天津市长芒苋的研究表明,长芒苋入侵到新的生物群落后会逐渐形成单一物种群落,挤压本土植物生存空间,造成当地生态系统多样性的破坏。
2.传播植物病原物
有研究表明,长芒苋可以作为南方根结线虫(Meloidogyne incognita)等多种线虫的寄主,增加了病虫害传播的可能性。
3.化感作用
长芒苋可以通过化感作用抑制多种作物的生长,营造自身的竞争优势。长芒苋地上部分的挥发物可以显著抑制胡萝卜、洋葱、番茄的种子萌发,阻碍其正常的生长发育。
4.抗药性
长芒苋由于其雌雄异株的特性,可以通过花粉介导的基因流来提升对除草剂的抗性。目前已经在世界各地发现多个抗除草剂的长芒苋抗性种群,包括抗草甘膦种群、抗甲磺草酮种群、抗草铵膦种群等等。
长芒苋通过以上多种机制营造自身种群优势,增强在群落中的竞争力。

图4 长芒苋为害状(中国植物图像库,2024)
长芒苋作为外来入侵杂草,具有较强的适应性。研究表明,长芒苋种子可以通过昆虫、动物和鸟类等进行近距离传播,种子通过动物消化道后仍具有很大的存活几率,也可以通过灌溉、水流、强风等进行远距离传播,经棉花、粮食、豆类及饲料等农产品携带是其主要的远距离传播途径。其种子的萌发和出苗对温度、光照、水分及播种深度要求不严格,增加了其传播扩散的能力。在中高纬度地区,长芒苋通常于5月初出苗(最低温度大于13℃即可出苗),5月中旬为出苗高峰期,6月中旬为分枝初期,7月上旬为抽穗初期,10月下旬植株开始逐渐枯黄死亡。有研究表明,在低纬度地区,长芒苋4月即可发芽从而进行入侵。
1. 加强植物检疫
长芒苋作为我国的进境植物检疫性有害生物,在农业生产中应当依据《中华人民共和国植物检疫条例》,对跨地区的种子运输、粮食运输等严格实施检疫,杜绝长芒苋种子随农副产品调运传入新的区域。
2. 精选种子
由于长芒苋繁殖率高、种子量大且微小,在农业生产中易随种子运输等进行远距离传播。因此,农作物种子在播种前要严格精选,发现带有长芒苋种子时,要彻底清除。
3. 物理防治
在长芒苋幼苗期至植株结子期进行人工或机械铲除。
4. 化学防治
在长芒苋2-3叶期,用2,4-滴丁酯乳油、灭草松水剂等进行防治。有研究报道,除草剂混用对长芒苋有较好的防治效果
曹晶晶, 王瑞, 刘万学, 万方浩, 郭建英. 基于种子发芽率评估长芒苋在我国不同纬度地区的入侵风险[J]. 植物保护, 2022, 48(06): 8-15.
车晋滇. 外来入侵杂草长芒苋[J]. 杂草科学, 2008, (01): 58-60.
陈程, 许昕妍, 严靖, 闫小玲. 入侵杂草长芒苋对草甘膦抗性机制的研究进展[J]. 农药, 2022, 61(09): 625-630.
国家市场监督管理总局. 长芒苋检疫鉴定方法: GB/T 40193-2021[S]. 2021.
韩建华, 王一帆, 王孟文, 周春敏, 王景震. 天津市主要危险外来入侵植物识别与防治技术[J]. 天津农林科技, 2018, (03): 16-19
吉美静, 崔海兰, 陈景超, 于海燕, 张金鹏, 李香菊. 影响长芒苋种子萌发因素的研究[J]. 杂草学报, 2021, 39(03): 8-14.
李永革, 曹晶晶, 王瑞, 黄雅凤, 陈慧民. 基于层次分析法的外来杂草长芒苋入侵河南省北部的风险评估[J]. 植物检疫, 2021, 35(05): 60-65.
李振宇. 长芒苋——中国苋属一新归化种[J]. 植物学通报, 2003, (06): 734-735.
徐晗, 赵彩云, 刘勇波, 陈鹏程, 李俊生. ITS序列及其SNP位点在外来入侵杂草长芒苋、西部苋和糙果苋物种鉴定中的应用[J]. 植物保护, 2017, 43(05): 128-133.
张航, 闫超杰, 郑壹鸣. 关注检疫性有害生物长芒苋的传播[J]. 中国海关, 2023, (09): 54.
张心怡, 赵健, 李志鹏, 王苗苗, 陈宏. 基于4种生态位模型的长芒苋潜在适生区预测[J]. 植物保护, 2023, 49(02): 73-82.
Carvalho-Moore P., Norsworthy J. K., González-Torralva F., Hwang J. I., Patel J. D., Barber L. T., Butts T. R. and McElroy J. S. Unraveling the mechanism of resistance in a glufosinate-resistant Palmer amaranth (Amaranthus palmeri) accession[J]. Weed Science. 2022, 70(4): 370-379.
Connick W. J., Bradow J. M. and Legendre M. G. Identification and bioactivity of volatile allelochemicals from amaranth residues. Journal of Agricultural and Food Chemistry[J]. 1989, 37(3): 792-796.
Amaranthus palmeri S. Watson in GBIF Secretariat (2023). GBIF Backbone Taxonomy. Checklist dataset https://doi.org/10.15468/39omei accessed via GBIF.org on 2024-05-31.
Kaspary T. E., García M. A. and Bellé C. The weed Amaranthus palmeri is a host of Meloidogyne incognita in Uruguay[J]. Rhizosphere. 2021, 19, 100400.
Li Y. M., Mo X. Q., Li Q. N., Liang C. H., Liu S. M., Zhang Y. W. and Zhang Z. Effects of an invasive plant Palmer Amaranth (Amaranthus palmeri) on herb communities[J]. IOP Conference Series: Earth and Environmental Science. 2021, 791.
Oliveira M. C., Gaines T. A., Patterson E. L., Jhala A. J., Irmak S., Amundsen K. and Knezevic S. Z. Interspecific and intraspecific transference of metabolism-based mesotrione resistance in dioecious weedy Amaranthus[J]. Plant Journal. 2018, 96(5): 1051-1063.
Ward S. M., Webster T. M. and Steckel L. E. Palmer Amaranth (Amaranthus palmeri): A Review. Weed Technology. 2013, 27(1): 12-27.
日本金龟子(Popillia japonica Newman)属于动物界 节肢动物门 昆虫纲 鞘翅目 丽金龟科 弧丽金龟属
日本金龟子食性杂,繁殖快,适宜条件下来势凶猛,破毁性大。以幼虫在地下为害,取食植物根部,尤其是草根。当土壤内幼虫虫口密度达到每立方米100-500头时会引起草地或菜地的植物成片死亡。成虫善飞,取食多种经济植物的花、果及叶片,使作物大面积减产[1-2]。
以幼虫(通常3龄)在土中越冬,深度15-30cm。春季,当土温超过10℃时,幼虫开始移至约5cm深处取食植物根部。经几周取食后化蛹。成虫羽化发生于5月末至7月,取决于当地的气候条件。1年发生1代,在分布区的北部2年1代。成虫喜欢在温暖、阳光充足的环境下取食聚集,并有结群迁移的习性[1-2]。
成虫出现1周后开始交尾,交尾后的雌成虫选择光线充足、潮湿、肥沃的酸性土壤(pH≤5.3)的草地或菜地产卵。雌虫先在土中钻出5-13cm深的洞,在洞中做室产卵,每室产卵3-4粒,每雌产卵平均50粒。卵期约两周,取决于温度条件[1-2]。
幼虫孵化后开始在土壤中危害植物的根系,在土壤中生活可长达12个月。卵孵化后,幼虫就开始取食附近寄主植物的细根,顺着细根取食,直至吃完为止;然后水平移至另一细根继续取食。幼虫在其身体周围保留有一个小室,在土壤中移动时,用上颚挖掘,并将土向身后堆积。受土壤温湿度的影响,幼虫在土壤中有时也垂直移动。在夏季,幼虫大多集中在地表至5cm 深的土层中。 年末,当土温下降时,幼虫向深处移动,直至10℃时停止活动。日本金龟子多以2或3龄的幼虫在5~15cm 深的土壤中越冬。当春季土壤温度上升至10℃时,它们便开始向地表移动[1-2]。
春季化蛹,蛹期约2周。在大部分分布区内,其成虫一般在6月从土中羽化而出,羽化高峰在7月底。雄成虫比雌性早几天羽化。在起飞觅食前,日本金龟子常停息于植物基部近地表处。成虫寿命在大田条件下30-45天。当温度达21.1℃和湿度低于60%时成虫开始飞翔,温度超过35℃时成虫不再飞翔,飞翔距离较近,一般为4.4km,若顺风飞翔可达8km[1-2]。
成虫体长9-15mm,宽4-7mm。宽卵圆形,具强的金属光泽。头短,呈金绿色或古铜色;唇基横长方形,前缘加厚切向上弯翘;触角9节,鞭部红褐色,鳃叶部3节,黑色;额区刻点粗密,两颊部的刻点细密。前胸背板强烈隆起,刻点粗大。鞘翅红黄色或褐色,具金属光泽,侧缘及后缘为墨绿色或暗褐色,或与鞘翅其他部位同色;每鞘翅有6行刻点,行2的刻点散乱且在近端部4/5处消失。背面观,腹部两侧各有5个白毛斑。臀板不被鞘翅完全遮盖,基部有2个白毛斑。雄虫胫节端有2个尖齿,跗节的前4节等长;雌虫胫节端的2个齿钝圆,跗节第一节长等于后3节长度之和。腹部着生淡灰色细毛。卵:白色或乳白色,椭圆形,长约1.6mm。幼虫:初孵幼虫白色,体长约1.5mm,老熟时体长达18-32mm。上颚发达,暗褐色。尾节膨大,蓝色或黑色,腹毛区的肛裂横弧形,其上有2列短刚毛,排成倒V字形排成倒V字形,每列6根[1-2]。

图1 日本金龟子的幼虫
(图片来源:CABI,2024)

图2 日本金龟子
(图片来源:CABI,2024)

图3日本金龟子
(图片来源:国门生物安全基础数据信息资源平台)

图4日本金龟子成灾
(图片来源:国门生物安全基础数据信息资源平台,2024)
1. 植物检验检疫措施
对来自疫区如日本、美国、加拿大、韩国等的寄主植物及植物产品特别是主要的一些寄主植物进行严格检疫,对疫区来的带土活植物应重点进行检疫。
对疫区来的运输工具进行检疫,重点查看食品舱、客机机舱、载货舱以及水果垃圾堆放点。现场检查时,对发现可疑危害症状的样品进行取样,取样应按照中华人民共和国动植物检疫法规定的操作规程进行;发现可疑害虫虫样立即置人备好的毒瓶内杀死,并详细记载有关的采集时间、采集地点、进境国家、寄主植物、运输工具、采集者、虫态和数量等信息资料[3]。
2.人工防除
对于小规模种植,可以采取手动清除。当温度低于21°C时,植物上的日本金龟子行动迟缓,可以通过将它们拨入一桶肥皂水等方式来灭除,高价值的植物,如玫瑰,可以在日本金龟子活动期间,在每个花朵周围使用细网面料进行保护[4]。
3.化学防治
关于日本金龟子成虫,可以通过使用碳酸酯类(carbamates)、有机磷酸酯类(organophosphates)或拟除虫菊酯类(pyrethroid insecticides)杀虫剂进行控制[5-6]。一些短效杀虫剂,如新烟碱类(imidacloprid)和蜕皮加速剂(halofenozide),对幼虫的控制有一定作用,可能产生超过1年的以上的防治效果[6-7]。
4.生物防治
美国在对生物防治日本金龟子方面做了较多的尝试和研究。1968年,美国农业部(USDA)引进了49以日本金龟子为寄主的寄生虫[8]。其中春黑小土蜂(Tiphia vernalis) 、奥裸背寄蝇(Istocheta aldrichi)建立了种群并有很好的效果[9]。美国还考虑了日本金龟子芽孢杆菌(Paenibacillus popilliae),但是此方法的效果和成本遭到质疑,未广泛应用[6,9]。还有苏云金芽孢杆菌日本亚种(Bacillus thuringiensis subsp. japonensis Ohba et al.) 和金龟子绿僵菌(Metarhizium anisopliae)也有很好的效果。在线虫中,斯氏线虫属(Steinernema)和异小杆属(Heterorhabditis)常用来防治日本金龟子,但线虫的使用需要保证足够的施用量和合适的环境[10-11]。
在我国,春黑小土蜂(Tiphia vernalis)是我国山东等地寄生多种金龟子幼虫的优势蜂种 之一[12]。以5%的蜂蜜水和蔗糖水为土蜂补充营养,以每8h更换一次寄主效果最好。日本金龟子芽孢杆菌(Paenibacillus popilliae)的防治效果较好,但其生长、出孢条件苛刻[13]。我国已有研究推动其生产商品化,根据菌液的体积,使用6g的硅藻土作为吸附剂吸附孢子20分钟经过干燥,既可以从菌液中回收得到有活性的孢子粉末。使用10%脱脂乳,8%海藻糖,2%甘油,0.2%谷氨酸作为保护剂的成分,同时调整保护剂的pH值为7.6,在这一条件下对孢子进行冻干,冻干后孢子的活性可以保持90%以上[14]。
[1] 陈宏.美国的日本金龟子[J].植物检疫,1997(04):29-33+37.
[2] 陈乃中.中国进境植物检疫性有害生物(昆虫卷)[M].北京:中国农业出版社,2009.
[3] 中华人民共和国国家质量监督检验检疫总局. 日本金龟子检疫鉴定方法: SN/T 1370-2004 [S]. 北京: 中国标准出版社.
[4] Blair A. USDA Home and Garden Bulletins[J]. Journal of Agricultural & Food Information, 2004, 6(2-3): 145-150.
[5] Potter D A. Destructive turfgrass insects: biology, diagnosis, and control[M]. John Wiley & Sons, 1998.
[6] Potter D A, Held D W. Biology and management of the Japanese beetle[J]. Annual review of entomology, 2002, 47(1): 175-205.
[7] George J, Redmond C T, Royalty R N, et al. HORTICULTURAL ENTOMOLOGY-Residual Effects of Imidacloprid on Japanese Beetle (Coleoptera: Scarabaeidae) Oviposition, Egg Hatch, and Larval Viability in Turfgrass[J]. Journal of Economic Entomology, 2007, 100(2): 431.
[8] Fleming W E. Biological control of the Japanese beetle (USDA Technical Bulletin 1383)[J]. US department of Agricul-ture, Washington, 1968.
[9] Jackson T A, Klein M G. Scarabs as pests: a continuing problem[J]. The Coleopterists Bulletin, 2006, 60(mo5): 102-119.
[10] Wright R J, Villani M G, Agudelo-Silva F. Steinernematid and heterorhabditid nematodes for control of larval European chafers and Japanese beetles (Coleoptera: Scarabaeidae) in potted yew[J]. Journal of Economic Entomology, 1988, 81(1): 152-157.
[11] Georgis R, Gaugler R. Predictability in biological control using entomopathogenic nematodes[J]. Journal of economic entomology, 1991, 84(3): 713-720.
[12] 陈红印,王树英,陈长风,等.日本金龟子幼虫寄生蜂春黑小土蜂人工繁殖技术研究[J].中国生物防治,2003(04):154-157.
[13] 丁莹,王若菡,王劲峰.日本金龟子芽孢杆菌生长和孢子生成阶段的特性研究[J].农药,2008(02):105-108.
[14] [1]李石. 体外培养的日本金龟子芽孢杆菌的回收及冷冻干燥保护剂的研究[D].天津大学,2012.
植物界 被子植物门 木兰纲 菊目 菊科 假泽兰属
薇甘菊的花、茎、叶和种子
(图片来源:https://m.gmw.cn/baijia/2022-12/16/36239268.html)
薇甘菊为多年生草质或木质藤本,茎细长,具棱,匍匐或攀缘,多分枝。茎中部叶三角状卵形至卵形,长4.0~13.0cm,宽2.0~9.0 cm,基部心形,偶近戟形,先端渐尖,边缘具数个粗齿或浅波状圆锯齿,基出3~7脉;叶柄长2.0~8.0 cm;上部的叶渐小,叶柄亦短。头状花序小,数目多,在枝端排成复伞花序状,复花序顶生或侧生,顶部的头状花序花先开放,依次向下逐渐开放。花有香气,花白色,头状花序长4.5~6.0 mm,5齿裂。瘦果长1.5~2.0mm,椭圆形,亮黑色,具5棱,1粒果子约相当于1粒芝麻的1/40重,果实顶端有冠毛,可随风和水传播[1]。薇甘菊具有无性繁殖和有性繁殖能力皆强的特点,在适宜的气候区,薇甘菊种苗只要落地沾土就能立刻生根发芽、开花结籽、建立种群并向四周扩散蔓延[2]。薇甘菊的主要入侵对象是天然次生林、水源保护林、农田区、海岸滩涂和红树林缘滩地等,其可迅速覆盖整个裸露地,或者攀援缠绕于乔灌木植物,一旦攀上树木就会缠绕全株植物,形成严密的覆盖层,一方面使植物的光合作用和对水分及营养的吸收受影响,另一方面使植物遭受物理重压,进而影响植物的生长甚至引起植物死亡,致使当地生物多样性减少,改变生态系统结构。薇甘菊在种间竞争中,可向周围环境释放化感物质,通过雨水淋溶、根系分泌、枯枝叶分解而作用于其他植物,从而抑制它们的生长,为其自身的生长创造更好的条件[3]。
1. 植物检验检疫措施
为防止薇甘菊在区域间远距离传播,对从区域外薇甘菊发生地进入的可疑植物运输工具,要进行检查检验,发现有薇甘菊藤茎、种子等,必须及时进行检疫除害处理。同时,也要防止从薇甘菊发生地将其根、茎、种子向外传出。
2.人工防除
当薇甘菊轻度或零星发生且便于人工清除时,可在每年的4~10月,薇甘菊生长最旺盛且未开花时,利用人工、机械等手段,在人易到达的范围内进行地毯式的砍伐和连根拔除。拔除的根部长度一般在20厘米左右,清除出来的藤和根要放在不接触到土壤的地方,让太阳暴晒几天或集中烧毁。连续人工清理几次,清除效果较好。相对而言,人工防除不会造成环境污染,但费时费工,还有可能促进薇甘菊的生长。因为人工清理遗落一段薇甘菊往往能长出数个新苗,且薇甘菊种子会随风飘动到下一年生长更广,影响防治效果[4]。
3.化学防治
目前对薇甘菊防治效果较好的药剂有草舒、草甘膦、紫薇清和薇草灵等除草剂[1]。使用草舒除治薇甘菊时,用药量要比药品说明书上的用药量大,可增加到45 kg/hm2。喷药时间选择在4~10月的晴天及露水干后。施药后约7d左右,薇甘菊开始死亡,6~7个月内基本不见有新的薇甘菊长出,若个别到方有再长出,需继续喷施1次药液,以达到根除薇甘菊的效果。紫薇清除草剂是杀灭薇甘菊的专用除草剂,可杀灭其根、茎、叶。一般十几天后,薇甘菊就会枯死。采用该方法防除薇甘菊,既可杀灭薇甘菊,又不污染水果。还可使用88.8%草甘膦铵盐可溶性粒剂杀灭薇甘菊的根、茎、叶。草甘膦是内吸传导型除草剂,故应在每年的4~10月的晴天或没有露水时,用88.8%草甘膦铵盐可溶性粒剂125倍液喷施,用药量为2250 L/hm2,均匀喷施在薇甘菊的茎、叶上。大约21d就可杀灭薇甘菊,连续用药2~3次可达到根除目的。但草甘膦是一种灭生性除草剂,在农作物附近使用时要特别注意,应尽量压低喷头,防止草甘膦飘散对旁边的作物造成药害。
4.生物防治
薇甘菊在美洲中南部危害较小,主要原因就是当地有很多薇甘菊的天敌存在,其中仅南美洲就有30多种天敌[5],可取食薇甘菊的根、茎、叶、花等不同部位。一些致病菌、昆虫以及螨类可危害薇甘菊,但由于不能建立稳定的种群,或可能对其他生物具有同样的威胁不能通过安全性测定,或致病力不高,从而限制了这些天敌的大量应用[6]。要想利用天敌达到防治薇甘菊目的,还需进一步深入研究。菟丝子可寄生于薇甘菊上,可极大减少薇甘菊的叶绿素含量、光合速率,最终影响其生物量,并且大大减少其开花及结实,对薇甘菊的生长和繁殖都具有显著的抑制作用,有望成为一种极富潜力的控制方法[7]。李艳美等[8]利用菟丝子的寄生属性来控制薇甘菊,结果表明,在薇甘菊发生较大区域里野菟丝子能寄生并致死薇甘菊,使样地群落中薇甘菊的覆盖度明显降低,不会对其他经济果林、粮食作物造成伤害,可保障生态安全性增加物种多样性;但对零星发生的薇甘菊,其控制率低于薇甘菊的扩散蔓延速度。同时,菟丝子本身也是检疫性杂草,在防治薇甘菊中也应慎重[9]。
[1]李瑞叶,林干琼.外来有害生物薇甘菊的发生与防治[J].农业灾害研究,2012,2(04):11-13+77.
[2]BS ISMAIL,A KUMAR. Effects of aqueous extracts and decomposition of Mikania micrantha H. B. K. debris on selected agronomic crops [J].Weed Biol Manag,2002,2:31-38.
[3]张茂新,凌冰,孔垂华等.薇甘菊挥发油的化感潜力[J].应用生态学报,2002(10):1300-1302.
[4]昝启杰,王伯荪,王勇军,等.外来杂草薇甘菊的分布及危害[J].生态学杂志,2000,19(6):58-61.
[5]韩诗畴,李开煌,罗莉芬,等.菟丝子致死薇甘菊[J].昆虫天敌,2002,24(1):7-14.
[6]韩诗畴,李丽英,彭统序,等.薇甘菊的天敌调查初报[J].昆虫天敌,2001,23(3):119-128.
[7]邓雄,冯惠玲,叶万辉,等.寄生植物菟丝子防治外来种薇甘菊研究初探[J].热带亚热带植物学报,2003,11(2):117-122.
[8]李艳美.潞西市薇甘菊危害现状及其防控措施[J].热带农业科学,2011,31(1):28-30,68.
[9]太红坤,顾中量,徐云川,等.检疫性杂草薇甘菊的研究进展[J].农业灾害研究,2011,1(2):59-62.
玉米晚枯病菌(Cephalosporium maydis Samra, Sabet et Hingorani)属于半知菌类(Deuteromycotina),丝孢纲(Hyphomycetes),丛梗孢目(Moniliales),丛梗孢科(Moniliaceae),头孢霉属(Cephalosporium)
在PDA上,菌落呈淡灰色,后变黑色。分生孢子梗从菌丝生出,直立,顶端生分生孢子,分生孢子梗长30 μm~250 μm。分生孢子聚成头状,透明,单细胞,椭圆形,大小(3.6 μm~14 μm)×(3 μm~3.6 μm)。
该病原菌侵染幼苗导致根系变褐坏死,近地叶片快速枯萎,叶子逐渐失去颜色并脱水,下节间可能出现红褐色至淡黄色条纹。茎部下面变干(特别是在节间)并凹陷、中空和萎缩。维管束闭塞,颜色由白色或浅黄色变为深黄色至褐色。在玉米乳熟后期出现明显症状,感病严重的植株易发生倒伏,造成籽粒不全,但受侵染的种子表面无症状。
玉米晚枯病(LWD)于1961-1962年在埃及首次发现和报道,并逐渐在其他国家报道,埃及(1961年)、印度(1970年)、匈牙利(1998年)、西班牙和葡萄牙(2011年)、以色列(2018年)以及尼泊尔(2015年)都有报道。在我国新疆玉米产区,1983年首次发现了玉米晚枯病,但目前我国还没有玉米晚枯病菌的大面积分布。该真菌主要通过种子传播,还可以以菌核和孢子在土壤或玉米残留物上长期存活。LWD对新国家的直接经济影响难以预测,除了产量损失外,它还可能产生严重影响,因为它可能导致农产品和设备流动受限、长期检疫和作物禁运。
加强海关检疫检查,严防该病原菌在我国大面积传播。
[1]陈克赟,王作镒.头孢霉属真菌侵染玉米初报[J].植物保护,1986,(06):39-38.
[2] Degani O. A Review: Late Wilt of Maize-The Pathogen, the Disease, Current Status, and Future Perspective. J Fungi (Basel). 2021 Nov 19;7(11):989.
[3] Degani O. Control Strategies to Cope with Late Wilt of Maize. Pathogens. 2021 Dec 23;11(1):13.
[4]何瑞玒,薛春生,刘思宁等.基于实时环介导等温扩增技术快速检测玉米晚枯病菌[J].植物检疫,2023,37(02):62-68.
玉米内州萎蔫病菌Clavibacter michiganensis subsp. nebraskensiss (Vidaver et al.) Davis et al.可引起玉米萎蔫病。1969年,该病菌在美国内布拉斯加州首次报道,至2021年,该病害在全世界的分布范围包括美国15个州,加拿大阿尔伯塔、曼尼托巴和安大略等3个省, 目前在我国尚无报道。该病菌是一种主要为害玉米维管束的毁灭性细菌,可以随种子等繁殖体进行远距离传播,病菌在种子中至少可存活1年。
玉米内州萎蔫病菌为革兰氏阳性菌,菌落多呈现橘黄色。其易被酸性溶液脱色,复染后在显微镜下呈现蓝色。玉米内州萎蔫病菌不产生孢子,无鞭毛,其菌落具有多型现象。其菌体整体呈现杆状,偶见球棒状,椭圆形,以及卵形。在酵母提取物培养基、PDA培养基以及添加了酵母提取物的合成培养基上生长缓慢,3-4天才有肉眼可见的菌落。该细菌具有四种不同的菌落类型,橘黄色流体型菌落是该菌的典型菌落,其菌落颜色会随着温度以及培养基种类而变化。
病原侵染分为两个时期:叶枯期和系统侵染的萎蔫期。叶枯期受侵染部位的组织发生坏死,形成枯斑;萎蔫期病菌在植物体内系统移动,通常会造成植株死亡。玉米植株的各个生长阶段均可受到玉米内州萎蔫病菌的侵染。苗期比成株期更易受到该菌感染。感病品种在苗期受侵染,可能发生系统侵染,造成植株死亡;成株期感病会造成侵染部位叶片坏死,产生褐色至灰色、与叶脉平行的坏死斑。
由玉米内州萎蔫病菌造成的玉米枯萎以及萎蔫病于1969年在美国内布拉斯加的中南部首次发现,随后迅速传播到相邻州(1973),并于1999年在加拿大安大略发生。 该病菌现今分布于美国、加拿大,目前在我国尚无发生的报道。
加强对来自美国以及加拿大的玉米种子及其制品的检疫,严防玉米内州萎蔫病菌进入我国。
Osdaghi, E., Robertson, A. E., Jackson-Ziems, T. A., Abachi, H., Li, X., Harveson, R. M. (2023). Clavibacter nebraskensis causing Goss's wilt of maize: Five decades of detaining the enemy in the New World. Molecular Plant Pathology, 24(7): 675–692.
Wise, K., Ruhl, G. Creswell, T. (2010). Goss's bacterial wilt and leaf blight. West Lafayette, IN, USA: Purdue University Extension Publication BP-81-W.
Calub, A.G., Compton, W.A., Gardner, C.O. Schuster, M.L. (1974). Reaction of 113 corn (Zea mays) genotypes to leaf freckles and wilt. Plant Disease Reporter, 58: 956–960.
© Copyright 2019 All Rights Reserved 上海交通大学玉米病虫草害防治技术数据库